Synthese und Charakterisierung koordinierter Aminylradikale:
der Vergleich von Phenoxyl- und Anilinoradikalen
Dissertation von Frank Nils Penkert
Download der Dissertation als PDF-Datei (7.9 MB)
Beitrag der Aminylradikale zu der bioanorganischen Chemie
Es gilt als gesichert, daß ungefähr die Hälfte aller bekannten Enzyme Metalloproteine sind, die ein oder mehrere Übergangsmetallionen (V, Mn, Fe, Co, Ni, Zn, Cu, Mo, W) in ihren Reaktionszentren beinhalten. Um die Reaktivität dieser Biomoleküle zu verstehen, muß die zugrundeliegende Koordinationschemie erst entschlüsselt werden.
Spektoskopische Methoden wie EPR- (electron paramagnetic resonance) und die Resonanz-Raman-Spektroskopie können gewinnbringend zur Aufklärung von Struktur-Funktionsbeziehungen solcher Enzyme eingesetzt werden. Jedoch ist die Extraktion von strukturellen Daten aus diesen Spektren weiterhin eine große Herausforderung, insbesondere da sowohl die Chemie als auch die Spektroskopie von Metall koordinierten Radikalen noch nahezu unverstanden ist.
Unser Ansatz um diese Wissenslücke zu schließen, basiert auf der Synthese von Modellverbindungen, die die strukturellen, chemischen und physikalischen Eigenschaften der Reaktionszentren von Enzymen nachbilden, sowie auf dem Design von Modellverbindungen, die es ermöglichen, Informationen über Radikalstabilitäten, Oxidationspotentiale und Spinaustauschwirkungen zwischen den organischen Radikalen und den Metallzentren zu erhalten.
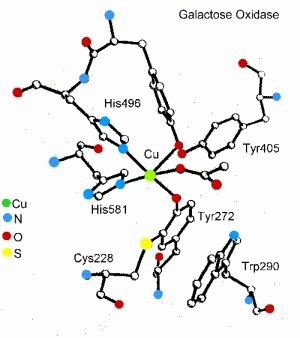 In einer Reihe von Redoxenzymen - so wie in Ribonucleotid-Reduktase, Cytochrom c Peroxidase, Prostaglandin Synthase und dem sauerstoff-produzierenden Komplex des Photsystems II - spielen Radikale aromatischer Aminosäuren (z.B. Tryptophan und Tyrosin) eine Schlüsselrolle im Katalysezyklus. Ein besonders faszinierendes Beispiel ist Galactose Oxidase - ein Enzym, das die Oxidation verschiedener Alkohole katalysiert. Hier bildet ein an ein Kupfer(II) koordiniertes substituiertes Tyrosylradikal ein neuartiges mononukleares Reaktionszentrum, in dem sowohl das Metall als auch der Ligand redox-aktiv sind. Vor kurzen konnte gezeigt werden, daß Glyoxal Oxidase ein Reaktionszentrum von vergleichbaren Typ besitzt, so daß das Metall koordinierte Tyrosylradikal kein einzigartiges Reaktionszentrum eines speziellen Enzyms ist, sondern wahrscheinlich ein gemeinsames strukturelles Motiv einer neuen Enzymfamilie beschreibt.
In vorherigen Studien zeigten wir [1], daß Übergangsmetallkomplexe mit Liganden des Typs (N-Phenolato)-substituierten 1,4,7-Triazacyclononan gute Modellsysteme sind, da durch elektrochemische Oxidation Liganden zentrierte Phenoxylradikale erhalten werden können.
In einer Reihe von Redoxenzymen - so wie in Ribonucleotid-Reduktase, Cytochrom c Peroxidase, Prostaglandin Synthase und dem sauerstoff-produzierenden Komplex des Photsystems II - spielen Radikale aromatischer Aminosäuren (z.B. Tryptophan und Tyrosin) eine Schlüsselrolle im Katalysezyklus. Ein besonders faszinierendes Beispiel ist Galactose Oxidase - ein Enzym, das die Oxidation verschiedener Alkohole katalysiert. Hier bildet ein an ein Kupfer(II) koordiniertes substituiertes Tyrosylradikal ein neuartiges mononukleares Reaktionszentrum, in dem sowohl das Metall als auch der Ligand redox-aktiv sind. Vor kurzen konnte gezeigt werden, daß Glyoxal Oxidase ein Reaktionszentrum von vergleichbaren Typ besitzt, so daß das Metall koordinierte Tyrosylradikal kein einzigartiges Reaktionszentrum eines speziellen Enzyms ist, sondern wahrscheinlich ein gemeinsames strukturelles Motiv einer neuen Enzymfamilie beschreibt.
In vorherigen Studien zeigten wir [1], daß Übergangsmetallkomplexe mit Liganden des Typs (N-Phenolato)-substituierten 1,4,7-Triazacyclononan gute Modellsysteme sind, da durch elektrochemische Oxidation Liganden zentrierte Phenoxylradikale erhalten werden können.
In meiner Arbeit beschäftige ich mich mit der Chemie von (N-Anilino)-substituierten 1,4,7-Triazacyclononan Übergangsmetallkomplexen und vergleiche die Aminylradikale mit den entsprechenden Phenoxylradikalen.
Obwohl Amino (NH2+) Radikale seit langer Zeit bekannt sind und ausgiebig untersucht wurden, sind noch keine koordinierten Aminyl (NH) Radikale publiziert (ein Mangan(I) koordinietes Aminylradikal, das von D. Sellmann [2] publiziert wurde, erwies sich im selben Jahr in einer Studie von W. Kaim als Mangan(II) [3]).
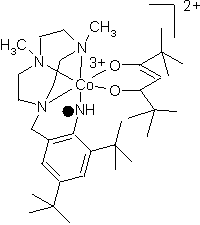 Es konnte gezeigt werden, daß durch elektrochemische Oxidation von (N-Anilino)-substituierten 1,4,7-Triazacyclononan Aminylradikale in Lösung erhalten werden konnten. Die EPR-, Resonanz-Raman- und UV-Vis Spektren sind gemessen und mit den entsprechenden (N-Phenolato) Derivaten verglichen. Die spektroskopischen Daten für die bisher erhaltenen Radikalkomplexe zeigen starke Ähnlichkeiten mit denen der entsprechenden Phenoxylradikale. Deswegen verspricht die weitere systematische Untersuchung dieser Komplexe ein besseres Verständnis der strukturellen und elektronischen Aspekte, welche die Rolle der Aminylradikale für mögliche natürliche und künstliche Katalysesysteme beschreiben.
Es konnte gezeigt werden, daß durch elektrochemische Oxidation von (N-Anilino)-substituierten 1,4,7-Triazacyclononan Aminylradikale in Lösung erhalten werden konnten. Die EPR-, Resonanz-Raman- und UV-Vis Spektren sind gemessen und mit den entsprechenden (N-Phenolato) Derivaten verglichen. Die spektroskopischen Daten für die bisher erhaltenen Radikalkomplexe zeigen starke Ähnlichkeiten mit denen der entsprechenden Phenoxylradikale. Deswegen verspricht die weitere systematische Untersuchung dieser Komplexe ein besseres Verständnis der strukturellen und elektronischen Aspekte, welche die Rolle der Aminylradikale für mögliche natürliche und künstliche Katalysesysteme beschreiben.
Literatur:
- [1]
- z.B. J. Müller,T. Weyhermüller, E. Bill, P. Hildebrandt, L. Ould-Moussa, T. Glaser, K. Wieghardt, Angw.Chem.Int.Ed. 1998, 37(5), 616-619
R. Schnepf, A. Sokolowski, J. Müller, V. Bachler, K. Wieghardt, P. Hildebrandt, J.Am.Chem.Soc. 1998, 120(10), 2352-2364
- [2]
- D. Sellmann, J. Müller, J.Organomet.Chem. 1985, 281, 249-262
- [3]
- R. Groß, W. Kaim, Angew.Chem. 1985, 97(10), 869-870
 In einer Reihe von Redoxenzymen - so wie in Ribonucleotid-Reduktase, Cytochrom c Peroxidase, Prostaglandin Synthase und dem sauerstoff-produzierenden Komplex des Photsystems II - spielen Radikale aromatischer Aminosäuren (z.B. Tryptophan und Tyrosin) eine Schlüsselrolle im Katalysezyklus. Ein besonders faszinierendes Beispiel ist Galactose Oxidase - ein Enzym, das die Oxidation verschiedener Alkohole katalysiert. Hier bildet ein an ein Kupfer(II) koordiniertes substituiertes Tyrosylradikal ein neuartiges mononukleares Reaktionszentrum, in dem sowohl das Metall als auch der Ligand redox-aktiv sind. Vor kurzen konnte gezeigt werden, daß Glyoxal Oxidase ein Reaktionszentrum von vergleichbaren Typ besitzt, so daß das Metall koordinierte Tyrosylradikal kein einzigartiges Reaktionszentrum eines speziellen Enzyms ist, sondern wahrscheinlich ein gemeinsames strukturelles Motiv einer neuen Enzymfamilie beschreibt.
In vorherigen Studien zeigten wir [1], daß Übergangsmetallkomplexe mit Liganden des Typs (N-Phenolato)-substituierten 1,4,7-Triazacyclononan gute Modellsysteme sind, da durch elektrochemische Oxidation Liganden zentrierte Phenoxylradikale erhalten werden können.
In einer Reihe von Redoxenzymen - so wie in Ribonucleotid-Reduktase, Cytochrom c Peroxidase, Prostaglandin Synthase und dem sauerstoff-produzierenden Komplex des Photsystems II - spielen Radikale aromatischer Aminosäuren (z.B. Tryptophan und Tyrosin) eine Schlüsselrolle im Katalysezyklus. Ein besonders faszinierendes Beispiel ist Galactose Oxidase - ein Enzym, das die Oxidation verschiedener Alkohole katalysiert. Hier bildet ein an ein Kupfer(II) koordiniertes substituiertes Tyrosylradikal ein neuartiges mononukleares Reaktionszentrum, in dem sowohl das Metall als auch der Ligand redox-aktiv sind. Vor kurzen konnte gezeigt werden, daß Glyoxal Oxidase ein Reaktionszentrum von vergleichbaren Typ besitzt, so daß das Metall koordinierte Tyrosylradikal kein einzigartiges Reaktionszentrum eines speziellen Enzyms ist, sondern wahrscheinlich ein gemeinsames strukturelles Motiv einer neuen Enzymfamilie beschreibt.
In vorherigen Studien zeigten wir [1], daß Übergangsmetallkomplexe mit Liganden des Typs (N-Phenolato)-substituierten 1,4,7-Triazacyclononan gute Modellsysteme sind, da durch elektrochemische Oxidation Liganden zentrierte Phenoxylradikale erhalten werden können.
 Es konnte gezeigt werden, daß durch elektrochemische Oxidation von (N-Anilino)-substituierten 1,4,7-Triazacyclononan Aminylradikale in Lösung erhalten werden konnten. Die EPR-, Resonanz-Raman- und UV-Vis Spektren sind gemessen und mit den entsprechenden (N-Phenolato) Derivaten verglichen. Die spektroskopischen Daten für die bisher erhaltenen Radikalkomplexe zeigen starke Ähnlichkeiten mit denen der entsprechenden Phenoxylradikale. Deswegen verspricht die weitere systematische Untersuchung dieser Komplexe ein besseres Verständnis der strukturellen und elektronischen Aspekte, welche die Rolle der Aminylradikale für mögliche natürliche und künstliche Katalysesysteme beschreiben.
Es konnte gezeigt werden, daß durch elektrochemische Oxidation von (N-Anilino)-substituierten 1,4,7-Triazacyclononan Aminylradikale in Lösung erhalten werden konnten. Die EPR-, Resonanz-Raman- und UV-Vis Spektren sind gemessen und mit den entsprechenden (N-Phenolato) Derivaten verglichen. Die spektroskopischen Daten für die bisher erhaltenen Radikalkomplexe zeigen starke Ähnlichkeiten mit denen der entsprechenden Phenoxylradikale. Deswegen verspricht die weitere systematische Untersuchung dieser Komplexe ein besseres Verständnis der strukturellen und elektronischen Aspekte, welche die Rolle der Aminylradikale für mögliche natürliche und künstliche Katalysesysteme beschreiben.